质量体系
1.质量标准
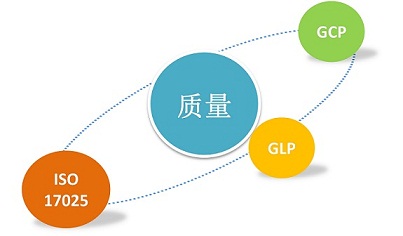
恒兴医药致力打造具有国际、国内最高质量标准的综合型质量体系。
|
|
◆OECD GLP ◆CNCA GLP ◆ICH GCP ◆CFDA GCP ◆ISO 17025
|
《GB/T 22278-2008 良好实验室规范(GLP)原则》(CNCA,2008)及相关补充细则;
《检测和校准实验室能力的通用要求》(ISO/IEC17025:2005-5-15);
《药物临床试验生物样本分析实验室管理指南(试行)》(CFDA,2011);
《药物临床试验质量管理规范(修订稿)》(CFDA,2016);
《中国药典2015版第四部,9012 生物样品定量分析方法验证指导原则》;
《药物I期临床试验管理指导原则(试行)》(CFDA,2011年第483号);
《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》(CFDA,2016年第61号);
2.质量管理体系
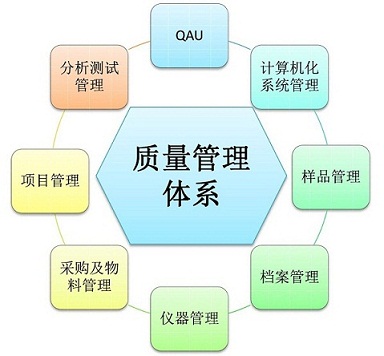
恒兴医药一直致力于质量管理体系的建立和完善,并不断提高自身管理水平:
 |
|
◆最新的指导原则(OECD/CNCA GLP)+完整的管理程序+专业的风险分级+实用的系统分类+针对性的生命周期,确保对其验证、备份、安全、角色管理、定期审核、退役进行全面管理。
◆完善的样品管理制度+独立的样品管理室+严格的权限隔离+“多套UPS+大功率柴油发电机”的供电连续方案+实时温湿度监测+健全的应急策略,以保证样品安全。
◆严格的“专人+指纹门禁”管理 +“一柜一锁、专项专柜”,以确保档案安全。
◆专人管理+独立完整日志簿+专业3Q验证+完善检定/校准/期间核查/定期维护+实时双重备份,以保证仪器设备测量结果准确性、可溯源性、真实性、安全性。
|
3.质量文件体系
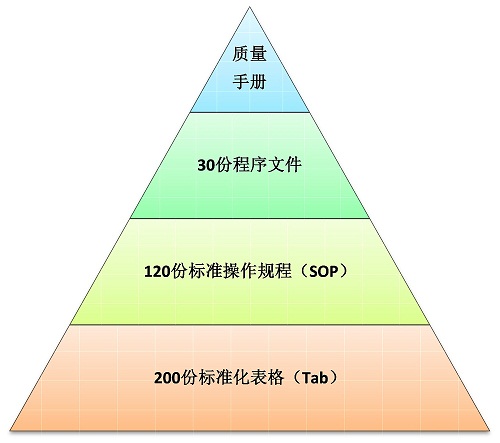
恒兴医药开创性的将GLP和ISO 17025进行有机结合,并形成完整健全的符合多方法规和行业要求的多级文件系统:
 |
|
◆质量手册:作为多级文件系统的首级文件,是本机构管理的纲领性文件。
◆程序文件:作为二级文件,是对质量手册相应条款的细化。
◆标准操作规程:作为三级文件,是用以指导实际运行中每个过程的文件;该级文件包括综合管理、组织及人员管理、实验室通用管理、采购管理、仪器设备管理、样品管理、项目管理、分析测试管理、计算机化系统管理、档案管理、质量保证管理等十一部分,共计120个文件,全面涵盖了GLP和ISO17025要求的各个要素。
◆标准化记录表格:作为四级文件,是实际运行中每个过程见证性的记录文件;该级文件均为中英文双语编制、全程表格化管理并实施严格的唯一编码跟踪受控,以确保记录文件的真实性、可追溯性。
|

