【恒兴大讲堂】药物的代谢活化与化学结构的关系及其机理(五)
来源:恒兴医药
正所谓一日不见如隔三秋,恒兴大讲堂迫不及待地想和大家见面,想和你说说,那些关于硝基芳烃、肼、硫脲、环丙胺和巯基/双硫键的故事......

硝基芳烃是常见的药物结构。大量含有芳香硝基的药物如呋喃妥英、尼鲁米特、氟他胺等都可以产生与该基团相关联的肝毒性①。一个例子是,治疗帕金森症的COMT抑制剂托卡朋在1998年被FDA批准后,因为很高的肝脏毒性发生率而被迫从全球多个市场上退出或受到严格的使用限制②。文献表明芳香硝基最主要的代谢途径就是通过P450催化的还原反应生成芳香胺,而在生成芳香胺的过程中形成亚硝酸、羟胺和硝基阴离子自由基等反应性中间体①。大部分含有芳香硝基的药物都可以在体内被还原为芳香胺而伴随生成这些反应性中间体,从而引发安全性担忧。也正是由于芳香硝基引发该类安全性隐患的广泛性和普遍性,现今在新设计和合成的药物分子中已经很少见到该基团了。

许多肼类药物表现出相当的毒性,如抗结核药物异烟肼、强力降压药肼屈嗪及抗肿瘤药丙卡巴肼均可导致严重的肝毒性甚至死亡③。




文献报道肼可经由包括P450在内的多种酶体系代谢活化为偶氮和重氮离子。比如异烟肼,在乙酰基转移酶的催化下生成乙酰异烟肼,其后水解为乙酰肼和异烟酸,乙酰肼再经由P450酶转化为反应性中间体乙酰偶氮,乙酰偶氮还可分解为反应性的乙酰正离子和乙酰自由基④;肼屈嗪在P450或过氧化物酶MPO的催化下形成反应性的偶氮物和重氮离子⑤;丙卡巴肼最开始是作为MAO的抑制剂而被合成出来的,但后来被发现具有抗肿瘤活性而被开发成抗肿瘤药物,该化合物可经由P450或MAO形成偶氮物和重氮离子⑥。

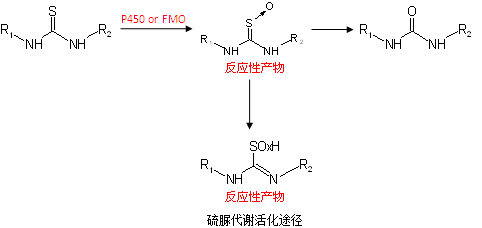
硫脲可经由P450和/或FMO催化的单加氧反应生成S-氧化物/次磺酸⑦而引起各种毒性包括甲状腺抑制, 肺水肿、肝坏死及生殖毒性等。S-氧化物可以被水解成低毒的脲而被快速排出体外,但也可以被继续氧化成S-二氧化物/亚磺酸和S-三氧化物/磺酸。这些具有亲电反应性的一系列S-氧化物被认为是产生毒性的原因⑦。含有硫脲结构的典型例子是抗结核药物氨硫脲和硫卡利特⑦,另一个例子是治疗甲状腺功能亢进的药物丙硫氧嘧啶。2009年FDA发布了一个关于丙硫氧嘧啶的黑框警告,称其“可能会对肝脏造成严重损害,包括肝衰竭,甚至可能导致病患死亡”。
环丙胺被认为是可以引起P450、MAO和ADH等多种药物代谢酶灭活的一种结构⑧。对于确定的通过单电子转移机制来氧化氨基的酶如MAO-B来说,脱氨氧化反应形成的α,β-不饱和醛/酮被视为使酶灭活的元凶⑨;而对于P450酶来说,其代谢活化的可能途径有多种⑧⑩,即1)通过单电子转移机制形成α,β-不饱和醛/酮,或2)直接的羟基化生成水合环丙酮而水合环丙酮是过氧化物酶⑪和ADH等⑩的强灭活剂。


广谱抗生素曲伐沙星于1997年获得FDA批准上市后,就出现多例严重的急性肾衰竭并导致死亡,最后该药被迫退出全球多国市场。从结构上来看,曲伐沙星包含两个可能产生活性代谢产物的位点,即环丙胺和二氟苯胺。为了探讨曲伐沙星肝毒性的具体原因,Qin等人合成出一个仅含有环丙胺结构的曲伐沙星结构类似物作为“模型”,将之与多种药物代谢酶共孵育之后进行代谢物检测,发现CYP1A2亚型酶可将该“模型”氧化为一种反应性的α,β-不饱和醛,由此推测,作为“原型”的曲伐沙星也可形成类似的α,β-不饱和醛/酮而产生肝毒性⑫⑬。

0 5
参考文献
①Boelsterli UA, Ho HK, Zhou S, et al. Bioactivation and hepatotoxicity of nitroaromatic drugs [J]. Curr Drug Metab, 2006, 7:715-727.
②Watkins P. COMT inhibitors and liver toxicity [J]. Neurology, 2000, 55:S51-52; discussion S53-56.
③Desrochers D, Gonzalez-Peralta RP, McClenathan DT, et al. Isoniazid-induced severe hepatotoxicity: an infrequent but preventable cause of liver failure in children treated for latent tuberculosis infection [J]. Clin Med Insights Pediatr, 2011, 5:9-13.
④Liu K, Li F, Lu J, et al. Role of CYP3A in isoniazid metabolism in vivo [J]. Drug Metab Pharmacokinet, 2014, 29:219-222.
⑤Zhou S, Chan E, Duan W, et al. Drug bioactivation, covalent binding to target proteins and toxicity relevance [J]. Drug Metab Rev, 2005, 37:41-213.
⑥Preiss R, Baumann F, Regenthal R, et al. Plasma kinetics of procarbazine and azo-procarbazine in humans [J]. Anticancer Drugs, 2006, 17:75-80.
⑦Nishida CR and Ortiz de Montellano PR. Bioactivation of antituberculosis thioamide and thiourea prodrugs by bacterial and mammalian flavin monooxygenases [J]. Chem Biol Interact, 2011, 192:21-25.
⑧Cerny MA and Hanzlik RP. Cyclopropylamine inactivation of cytochromes P450: role of metabolic intermediate complexes [J]. Arch Biochem Biophys, 2005, 436:265-275.
⑨Malcomson T, Yelekci K, Borrello MT, et al. cis-cyclopropylamines as mechanism-based inhibitors of monoamine oxidases [J]. FEBS J, 2015,
⑩Cerny MA and Hanzlik RP. Cytochrome P450-catalyzed oxidation of N-benzyl-N-cyclopropylamine generates both cyclopropanone hydrate and 3-hydroxypropionaldehyde via hydrogen abstraction, not single electron transfer [J]. J Am Chem Soc, 2006, 128:3346-3354.
⑪Shaffer CL, Morton MD, and Hanzlik RP. Enzymatic N-dealkylation of an N-cyclopropylamine: an unusual fate for the cyclopropyl group [J]. J Am Chem Soc, 2001, 123:349-350.
⑫Sun Q, Zhu R, Foss FW, Jr., et al. In vitro metabolism of a model cyclopropylamine to reactive intermediate: insights into trovafloxacin-induced hepatotoxicity [J]. Chem Res Toxicol, 2008, 21:711-719.
⑬Sun Q, Zhu R, Foss FW, Jr., et al. Mechanisms of trovafloxacin hepatotoxicity: studies of a model cyclopropylamine-containing system [J]. Bioorg Med Chem Lett, 2007, 17:6682-6686.
⑭Mohanasundaram KA, Haworth NL, Grover MP, et al. Potential role of glutathione in evolution of thiol-based redox signaling sites in proteins [J]. Front Pharmacol, 2015, 6:1.
⑮Mizutani T, Yoshida K, Murakami M, et al. Evidence for the involvement of N-methylthiourea, a ring cleavage metabolite, in the hepatotoxicity of methimazole in glutathione-depleted mice: structure-toxicity and metabolic studies [J]. Chem Res Toxicol, 2000, 13:170-176.
⑯Piepho RW. Overview of the angiotensin-converting-enzyme inhibitors [J]. Am J Health Syst Pharm, 2000, 57 Suppl 1:S3-7.
⑰Miron T, Listowsky I, and Wilchek M. Reaction mechanisms of allicin and allyl-mixed disulfides with proteins and small thiol molecules [J]. Eur J Med Chem, 2010, 45:1912-1918.
下期我们将会聊到关于3-甲基吲哚衍生物、酰亚胺、溴苯、碘苯、炔、芳基乙酸的代谢活化途径,欢迎大家留言参与讨论,那么我们下期再见咯!

