【恒兴大讲堂】药物的代谢活化与化学结构的关系及其机理(二)
来源:恒兴医药
上一期,我们对药物的代谢活化和毒性作用简单的描述了一下。那么有哪些物质会通过代谢活化产生毒性呢?它的代谢途径又是怎么样的呢?让我们继续往下看。
一、生成醌类物质的结构
醌类物质(醌、亚胺醌和亚甲基醌)可通过亲电加成反应与蛋白质和DNA形成复合物而造成毒性①。
氢醌或邻苯二酚容易经由P450酶或过氧化物酶介导的氧化脱氢反应而转变为醌,如多巴胺②。有一些其它结构可通过代谢反应形成氢醌或邻苯二酚而最终转化为醌,如苯酚和苯酚醚等。雌二醇和己烷雌酚为苯酚结构,其苯环上羟基的邻位可再被羟基化而形成邻苯二酚③; 用于抗菌、降血压以及作为香精的丁香酚为苯酚醚结构,其醚键可以发生O-去烃基反应而生成邻苯二酚④
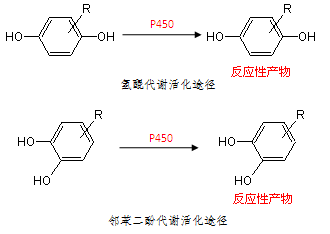

对乙酰氨基酚,通过P450酶或COX酶介导生成亚胺醌类物质N—乙酰对苯亚胺醌而产生肝毒性,严重时可致人死亡⑤。
抗疟药阿莫地喹也可生成亚胺醌⑥,其引发生命威胁性的肝毒性和粒细胞缺乏症的几率高达1/2000。
氨基苯酚可通过代谢反应生成亚胺醌。一些结构可先通过代谢转化为氨基苯酚,继而生成亚胺醌,这样的例子有苯胺和氨基苯醚等。前者如非甾体抗炎药双氯芬酸⑦,先通过羟基化在氨基苯环上引入对位酚羟基,再生成亚胺醌;后者如如β受体阻滞剂普拉洛尔⑧,首先通过O-去烷基反应暴露出酚羟基,继而生成亚胺醌。


烷基苯酚和烷基苯醚则可生成亚甲基醌。前者如食品添加剂2,6-二叔丁基对甲酚⑨和糖尿病药物曲格列酮⑩可经P450酶分别氧化为对位和邻位亚甲基醌;后者如抗雌激素他莫昔芬⑪和钾离子通道开放剂BMS-204352⑫可先通过P450酶发生O-去烃基反应后,再继续被分别氧化为亚甲基醌

二、苯胺(Alinine)
苯胺除了可能通过氨基苯环上的羟基化生成亚胺醌,也可以通过氨基上的羟基化形成反应性的羟胺,继续氧化形成反应性的亚硝基,而最终生成稳定的硝基化产物,如抗心律失常药物普鲁卡因胺⑬和抗菌药磺胺甲恶唑⑬。显然,苯胺最终转化为反应性亚硝基结构的前提是其为伯胺的形式。普拉洛尔分子中的苯胺为仲胺,但是可通过水解反应转化成伯胺,继而形成亚硝基⑧。理论上,伯胺氮原子上的电子云密度越高,越容易发生羟基化继而转化为亚硝基,一篇对氨苯砜及其苯胺对位取代物的研究证实了这一点。研究者发现,氨苯砜分子中苯胺4-位上的取代基的对位取代常数越高,形成的新化合物的毒性越高⑭。

三、1,3-苯并二噁茂
1,3-苯并二噁茂存在于诸多天然异物如黄樟素的分子结构中。许多化学合成物中也具有该结构,如抗抑郁药物帕罗西汀和选择性内皮素A受体拮抗剂西他生坦等。1,3-苯并二噁茂保留了富电子的芳环结构,与其结构类似物邻苯二酚相比更稳定,因此其经常替代邻苯二酚作为某些药物药效团的组成部分。另外,1,3-苯并二噁茂比邻苯二酚非极性更强,因此也使化合物具有更高的大脑渗透性,这对中枢神经系统药物来说非常重要。

文献认为,1,3-苯并二噁茂类化合物可经由两种途径被代谢活化:1)先经过P450介导生成邻苯二酚,继而被进一步氧化形成邻位醌;2)被P450氧化性成反应性极高的亚甲基卡宾中间体。如帕罗西汀对CYP2D6的机理性抑制⑮和西他生坦的体内毒性⑯均被认为通过这两个途径而引起。
参考文献
①Chenna A,Hang B,Rydberg B,et al.The benzene metabolite p-benzoquinone forms adducts with DNA bases that are excised by a repair activity from human cells that differs from an ethenoadenine glycosylase [J].Proc Natl Acad Sci U S A, 1995,92:5890-5894.
②Goncalves LL,Ramkissoon A,and Wells PG.Prostaglandin H synthase-1-catalyzed bioactivation of neurotransmitters,their precursors,and metabolites:oxidative DNA damage and electron spin resonance spectroscopy studies [J].Chem Res Toxicol,2009,22:842-852.
③ Cavalieri EL,Rogan EG,and Chakravarti D.Initiation of cancer and other diseases by catechol ortho-quinones:a unifying mechanism [J].Cell Mol Life Sci,2002,59:665-681.
④ Sakano K,Inagaki Y,Oikawa S,et al.Copper-mediated oxidative DNA damage induced by eugenol:possible involvement of O-demethylation [J].Mutat Res,2004,565:35-44.
⑤Jiang Y,Fan X,Wang Y,et al.Schisandrol B protects against acetaminophen-induced hepatotoxicity by inhibition of CYP-mediated bioactivation and regulation of liver regeneration [J].Toxicol Sci,2015,143:107-115.
⑥ Lobach AR and Uetrecht J.Involvement of myeloperoxidase and NADPH oxidase in the covalent binding of amodiaquine and clozapine to neutrophils:implications for drug-induced agranulocytosis [J].Chem Res Toxicol,2014, 27:699-709.
⑦Poon GK,Chen Q,Teffera Y,et al.Bioactivation of diclofenac via benzoquinone imine intermediates-identification of urinary mercapturic acid derivatives in rats and humans [J]. Drug Metab Dispos,2001,29:1608-1613.
⑧Argikar UA,Mangold JB,and Harriman SP.Strategies and chemical design approaches to reduce the potential for formation of reactive metabolic species [J].Curr Top Med Chem,2011,11:419-449.
⑨ Lewis MA,Yoerg DG,Bolton JL,et al.Alkylation of 2'-deoxynucleosides and DNA by quinone methides derived from 2,6-di-tert-butyl-4-methylphenol [J].Chem Res Toxicol,1996,9:1368-1374.
⑩Kassahun K,Pearson PG,Tang W,et al.Studies on the metabolism of troglitazone to reactive intermediates in vitro and in vivo.Evidence for novel biotransformation pathways involving quinone methide formation and thiazolidinedione ring scission [J].Chem Res Toxicol,2001,14:62-70.
⑪Fan PW and Bolton JL.Bioactivation of tamoxifen to metabolite E quinone methide:reaction with glutathione and DNA [J].Drug Metab Dispos,2001,29:891-896.
⑫Zhang D, Ogan M,Gedamke R,et al.Protein covalent binding of maxipost through a cytochrome P450-mediated ortho-quinone methide intermediate in rats [J].Drug Metab Dispos,2003,31:837-845.
⑬Yang M,Chordia MD,Li FP,et al.Neutrophil- and Myeloperoxidase-Mediated Metabolism of Reduced Nimesulide:Evidence for Bioactivation [J].Chemical Research in Toxicology,2010, 23:1691-1700.
⑭Mahmud R,Tingle MD,Maggs JL,et al.Structural basis for the haemotoxicity of dapsone:the importance of the sulphonyl group [J].Toxicology,1997,117:1-11.
⑮Bertelsen KM,Venkatakrishnan K,Von Moltke LL,et al.Apparent mechanism-based inhibition of human CYP2D6 in vitro by paroxetine:comparison with fluoxetine and quinidine [J].Drug Metab Dispos,2003,31:289-293.
⑯Erve JC,Gauby S,Maynard JW,Jr.et al.Bioactivation of sitaxentan in liver microsomes,hepatocytes,and expressed human P450s with characterization of the glutathione conjugate by liquid chromatography tandem mass spectrometry [J].Chem Res Toxicol,2013,26:926-936.
下期我们将会聊到关于5-烷氧基吲哚、呋喃、噻吩及噻唑的代谢活化途径,欢迎大家留言参与讨论,那么我们下期再见咯!

